Examen PCE UNED Química 2020
Estructura del examen Química PCE UNED 2020
Índice
- Tipología
- Modalidad
- Instrucciones
- Características y diseño de la prueba
- Ejemplo de examen
- Criterios generales de corrección
Tipología
La prueba consiste en una parte tipo test y otra de desarrollo.
Modalidad
La modalidad de Química corresponde a Ciencias.
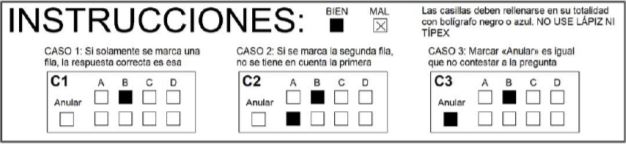
Instrucciones
El estudiante dispondrá de 90 minutos para realizar la prueba.
No puede tener ningún objeto o material cerca o encima de la mesa en la que realiza el examen.
El examen se escribirá con tinta azul o negra, no roja o verde ni lápiz.
Se recomienda no utilizar corrector (Tipp-Ex), porque el lector óptico
puede no reconocer las respuestas de opción múltiple.
Las preguntas de tipo test se contestarán necesariamente en la hoja proporcionada para tal fin, no pudiéndose hacer en la misma ninguna anotación en ninguna de las dos caras de la misma.
¿Quieres superar los exámenes con éxito?
Características y diseño de la prueba
La prueba constará de dos partes sobre los contenidos establecidos en el Real Decreto 1105/2014, de 26 de diciembre, por el que se establece el currículo básico de la Educación Secundaria Obligatoria y del Bachillerato (BOE Núm. 3, 3 de enero de 2015).
La prueba de evaluación consistirá en una única opción dividida en dos bloques: una depreguntas objetivas (tipo test) y otra de preguntas abiertas, (preguntas de desarrollo).
Bloque 1: Constará de diez preguntas objetivas de tipo test, cada una con tresposibles alternativas. El alumno deberá elegir la alternativa que considerecorrecta. Una sola de las alternativas es correcta. Las preguntas estaránrelacionadas con problemas o cuestiones del programa.
La calificación máxima de este bloque es de 4 puntos:
Cada pregunta correcta sumará 0,4
Cada pregunta incorrecta restará 0,15
Las preguntas en blanco no suman ni restan en el cálculo final.
Bloque 2: Consistirá en dos preguntas abiertas o de desarrollo de tipo problemasy/o cuestionesrelacionadas con aspectos fundamentales del programa, y quepodrán, a su vez, contener varios apartados.El enunciado de las preguntas incluirá todos los datos que sean necesarios para su correcta resolución. Máximo 6 puntos.
Ejemplo de examen
Lea atentamente las siguientes instrucciones:
El examen se escribirá con tinta azul o negra, no roja o verde ni lápiz.
No utilice ningún corrector (Tipp-Ex), porque el lector óptico puede no reconocer la respuesta.
No puede utilizar ningún material.
Dispondrá de 90 minutos para hacer el examen.
Bloque 1
1. Ajuste la siguiente reacción: Hidrógeno gaseoso reacciona con monóxido de carbono para formar metanol, CH3OH.
2. Una conocida marca comercial de sal yodada contiene 0.010% en masa de yoduro de potasio (KI). ¿Cuántos mol de KI se encuentran en un paquete ordinario de esta sal, cuya masa es de 1000g? Masas atómicas: K=39.10; I=126.9 uma.A very famous place that you might see in the film ‘the Beach’ is:
3. Una sustancia pura o especie química puede definirse como:
a) Todos aquellos átomos, iones o sus agrupaciones que pueden encontrarse separadamente en un sistema
4. . Para los siguientes conjuntos de números cuánticos indica cual es el correcto para el ultimo electrón del Azufre (Z=16):
5. Para el Trifloruro de Boro (B: z=5) indica que geometría y que hibridación presentará:
6.Para las siguientes afirmaciones elige la falsa:
7. Calcula los moles contenidos en 20 g de Au. Masa atómica: Au=197 g/mol
8. La nomenclatura correcta para el Sn(OH)2 es:
9. Para las siguientes sustancias: KBr, HF, K. Elige la que sea un buen conductor de la electricidad de estado fundido pero no en estado solido.
10. Los aldehídos y cetonas son compuestos orgánicos oxigenados que:
a) Pueden sufrir reacciones de oxidación y reducción.
b)Solo pueden sufrir reacciones de reducción.
c) Solo pueden sufrir reacciones de oxidación
Bloque 2.
- Pregunta 1: Responda a la siguiente cuestión (3 puntos):
En un recipiente de 14 litros se introducen 3’2 moles de N2(g) y 3 moles de H2(g). Cuando se alcanza el equilibrio: N2(g) + 3H2 (g) —–> 2NH3(g) a 200ºC se obtienen 1’6 moles de amoniaco. Calcule: – El numero de moles de H2(g) y de N2(g) en el equilibrio.
2. Pregunta 2. Responda a las siguientes cuestiones (3 puntos):
a. Escribe las fórmulas desarrolladas e indica el tipo de isomería que presentan entre sí el etilmetiléter y 1-propanol.
b. Indica si el siguiente compuesto halogenado CH3 CHBr-CH2-CHOH-CH2-CH3 tiene isomería óptica. Razona la respuesta en función de los carbonosasimétricos que pueda presentar.
¿Quieres superar los exámenes con éxito?
Criterios generales de corrección
De acuerdo con unos criterios generales de corrección, aplicables a los exámenes de todas las materias, se tendrán en cuenta específicamente:
Para la corrección de la materia de Química, se tendrán en cuenta, además, los siguientes aspectos:
•El uso adecuado del lenguaje químico en lo referente a nomenclatura yformulación, tanto inorgánica como orgánica.
•El planteamiento y ajuste correcto, en caso necesario, de las ecuaciones querepresentan las reacciones químicas.
•El correcto planteamiento y desarrollo seguidos en la resolución de los problemas,así como la correcta interpretación y expresión de los resultados numéricos en lasunidades apropiadas.
•El rigor y la claridad utilizados en la definición de conceptos.
•La presentación clara, legible y ordenada del examen, respetando la ortografía.
Bloque 1: preguntas objetivas (tipo test): Constará de 10 preguntas, nosiendo obligatorio contestar a todas las cuestiones.
La calificación máxima de este bloque es de 4 puntos-Cada pregunta correcta sumará 0,4-Cada pregunta incorrecta restará 0,15-Las preguntas en blanco no suman ni restan en el cálculo final.
Bloque II: preguntas abiertas (de desarrollo): Constará de 2 preguntas quepuntuaran por igual, no siendo obligatorio contestar a todas las cuestiones. La calificación máxima de este bloque es de 6 puntos. Las preguntas o apartados en los que se pide que razone o justifique la respuesta se puntuarán con un 20% de su valor en el caso de no realizarse dicho razonamiento o justificación.
La calificación final de la prueba será la suma de las puntuaciones obtenidas en los dos bloques, el bloque de preguntas objetivas (test) y el bloque de desarrollo, sin necesidad de notas mínimas en ninguna de las dos partes
Dada la naturaleza de esta materia, insistimos en recordar la importancia de la expresión, la ortografía y la correcta puntuación. Los fallos en estos aspectos serán penalizados con más rigor que en el resto de las materias, es decir, sin limitarse a la deducción máxima de 2 puntos sobre la nota del examen que está establecida para las demás materias de la prueba. La penalización obedecerá al criterio del corrector, que especificará en cada caso la puntuación deducida de la nota total. Aún así, de manera orientativa se detraerá 0,15 por cada falta de acentuación y puntuación y 0,25 por cada falta ortográfica. Ante errores graves de expresión se podrá incluso anular el examen; se entienden como errores graves la reiteración en el incumplimiento de las normas de corrección idiomática u ortográfica, así como los problemas de expresión que dificulten la lectura del texto del examen o su inteligibilidad (incluidas las faltas en la puntuación). En caso de conflicto por estas cuestiones, la coordinadora será responsable de la decisión final.